Die EHEC-Komplikation hämolytisch-urämisches Syndrom lässt sich mit Eculizumab preiswert behandeln; via telepolis.
Ich finde ja, bei einem Ampullenpreis von 5.800 Euro sollten wir uns mal 20 Millionen Dosen ins gesundheitsministeriale Kühlregal legen. Nur zur Sicherheit, wegen Bio-Terrorismus und so.
#PML-Risikoeinschätzung: Patient vs. Arzt
Eine Studie aus dem Jahr 2009 zeigt, dass Tysabri-Patienten ähnliche Kompetenzen im Umgang mit Zahlen und Risiken haben wie Ihre Ärzte. Das UKE-Hamburg hat das in der Studie verwendete Merkblatt zum PML-Risiko (aktualisiert) sowie Kontrollbögen zum Ausfüllen für Patienten und Ärzte jetzt onlinegestellt. Mal sehen wer gewinnt.
#podtime – Arbeit einfach in die Tonne treten
MONTAGVORMITTAG Wo soll man sich bloß hinlegen, wenn einen in Büro oder Werkstatt die Fatigue ereilt? Jon Gray hat die Antwort: Er verkauft Schlafröhren zum Schutz vor quengeligen Chefs und Kunden; via ftd.
Mit dem richtigen neuropsychologischen Attest übernimmt die Kosten (zwischen 1.700 und 2.300 Euro) sicher der Integrationsfachdienst. Selber kündigen geht aber schneller.
[Update 31.05] OSTRICH – ein alternatives Konzept, besonders geeignet für spontane Zusammenbrüche:

ratet mal ….
… was heute für ein Tag ist? Genau …:
«Ein Handtuch ist so ungefähr das Nützlichste, was der interstellare Anhalter besitzen kann. Einmal ist es von großem praktischem Wert – man kann sich zum ( …) und nass ist es eine ausgezeichnete Nahkampfwaffe.» ( Per Anhalter durch die Galaxis, Kap.3 )
In diesem Sinne, don’t panic!
#AnatOnMe
… ein Gerät, das anatomisch korrekte Bilder auf die Haut projiziert, um Patienten physiothera- peutisch zu motivieren: Weiterlesen
Wer will da noch gesund werden?
Unter Viagra (Sildenafil) war die (schlechtere) Hälfte der EAE-Mäuse nach acht Tagen praktisch symptomfrei …
Gewiss profitierten vorrangig die Nager von der Therapie. Die Mäuschen dagegen verharrten duldungsstarr in der Käfigecke.
#Fampyra: Zulassung in Europa doch möglich
ZUG (dpa-afx) Laut Biogen Idec hat der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) seine negative Einschätzung zu Fampyra (Fampridin 10 mg Retard-Tabletten) revidiert. Es wird eine eingeschränkte Genehmigung von Fampyra empfohlen. Biogen Idec hofft, das Medikament binnen 67 Tagen zur Behandlung von MS-Patienten (EDSS 4 bis 7) vermarkten zu dürfen. Für eine uneingeschränkte Zulassung von Fampyra muss Biogen Idec allerdings noch weitere Beweise über die langfristige Sicherheit und Wirkung des Medikaments vorlegen: 19 May 2011 Positive opinion on the marketing authorisation for Fampyra (Pdf)
Nicht nur den MS-Reporter wird’s freuen …
Tysabri: Statistisches PML-Risiko (März 2010 vs. Mai 2011)
Die Darstellung beruht auf den zum 4. Mai 2011 von Biogen Idec bestätigten 124 PML-Fällen und den Anwenderzahlen vom 31. März 2011. Bis zu diesem Zeitpunkt wurden laut Unternehmens-angaben insgesamt weltweit etwa 83.300 Patienten mit Tysabri® (Natalizumab) behandelt:
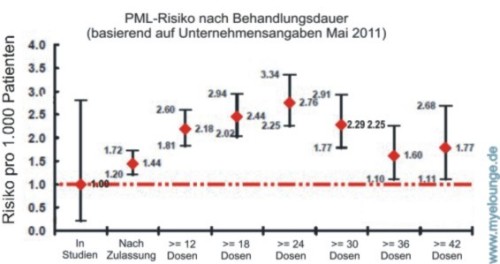
Da die Zahlen sich laufend verändern, handelt es sich um eine Momentaufnahme. Aufschlussreicher ist der Vergleich mit früheren Datenreihen. Weiterlesen